前回は「ばね」を例に、計算問題を解くコツをお伝えしました。
今回は化学計算の中でも苦手にする受験生が多い「中和反応」について紹介いたします。
中和反応とは
中和反応とは「酸とアルカリの性質が互いに打ち消されていく変化」のことです。
中学入試では、塩酸と水酸化ナトリウム水溶液の中和反応が頻出です。

中和反応は酸とアルカリが反応して水ができる反応であるともいえます。
そして、化学反応の計算で最も重要なのが「過不足なく反応する点(当量点)」です。
これを完全中和といい、当量点を基準として倍率を計算していきます。
※実際には塩酸にとけている塩化水素と水酸化ナトリウム水溶液にとけている水酸化ナトリウムが反応しています。
中和反応計算の基本
中和反応をはじめとする化学反応の計算には以下のような<手順>があります。
- <手順1>
基準=過不足なく反応する点(当量点)をメモしましょう。
※中和のときは「完全中和点」 - <手順2>
問われている条件を<手順1>のメモの下に追記しましょう。 - <手順3>
基準から何倍の量になっているのかをメモします。 - <手順4>
<手順3>でメモした倍率のうち、最小倍率を用いて計算しましょう。最重要! - <手順5>
中和反応では「余った水溶液(または溶質)」の種類で液性が決まります。- 塩酸(塩化水素)が余る
→混合液は酸性になる
→蒸発させると固体は1種類(食塩)のみ残る - 水酸化ナトリウム水溶液(水酸化ナトリウム)が余る
→混合液はアルカリ性になる
→蒸発させると固体は2種類(食塩・水酸化ナトリウム)が残る
- 塩酸(塩化水素)が余る
例題で確認しよう
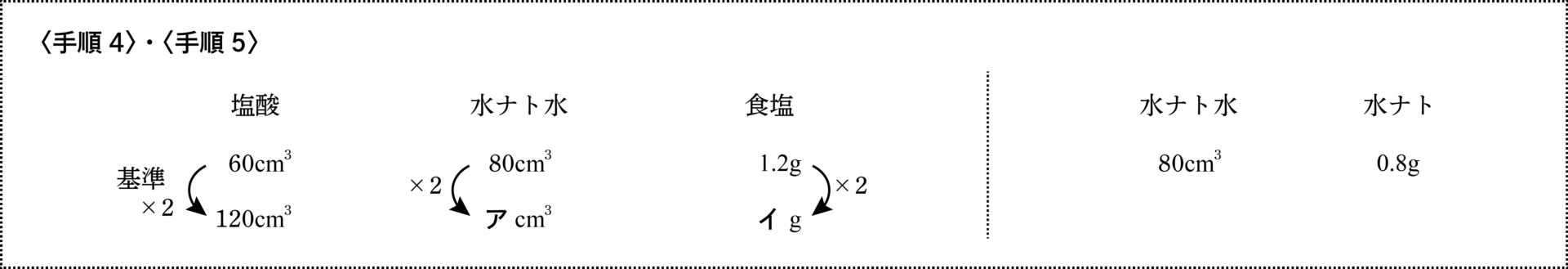
あるこさの塩酸$60\rm{cm}^3$に水酸化ナトリウム水溶液$80\rm{cm}^3$を加えると完全中和しました。この液を加熱して水分を蒸発させると、$1.2\rm{g}$の食塩が残りました。また、この水酸化ナトリウム水溶液を別に$80\rm{cm}^3$加熱すると、$0.8\rm{g}$の水酸化ナトリウムが残りました。
- 塩酸$120\rm{cm}^3$を完全中和するには、水酸化ナトリウム水溶液が何$\rm{cm}^3$必要ですか。また、その混合液を加熱して水分を蒸発させると、食塩が何g残りますか。
- 塩酸$80\rm{cm}^3$と水酸化ナトリウム水溶液$100\rm{cm}^3$を混ぜると何性になりますか。また、その混合液を加熱して水分を蒸発させると、あとに固体が何$\rm{g}$残りますか
- 塩酸$75\rm{cm}^3$と水酸化ナトリウム水溶液$120\rm{cm}^3$を混ぜると何性になりますか。また、その混合液を加熱して水分を蒸発させると、あとに固体が何$\rm{g}$残りますか。
さて、上記の問題を手順通りに解説してみましょう。
※基準に体積比(塩酸:水酸化ナトリウム水溶液$=3:4$)を用いても解くことができますが、今回は具体的な体積で計算していきます。
【解説】(1)を手順通りに解く
 塩酸が基準の2倍の量になっています。
塩酸が基準の2倍の量になっています。
このことから、「(完全中和するために)必要な水酸化ナトリウム水溶液の量」も「できる食塩の重さ」も2倍になります。
<手順4>と<手順5>に進みます。
ア$=80×2=\underline{160\rm{cm}^3}$…… 必要な水酸化ナトリウム水溶液
イ$=1.2×2=\underline{2.4\rm{g}} $…… できる食塩の重さ
【解説】(2)を手順通りに解く
 塩酸は基準の$\frac{4}{3}$倍に、水酸化ナトリウム水溶液は基準の$\frac{5}{4}$倍になっています。
塩酸は基準の$\frac{4}{3}$倍に、水酸化ナトリウム水溶液は基準の$\frac{5}{4}$倍になっています。
この場合は、最小倍率である$\frac{5}{4}$倍を用いて計算をします。
(つまり、大きい方の倍率は計算に使いません。)
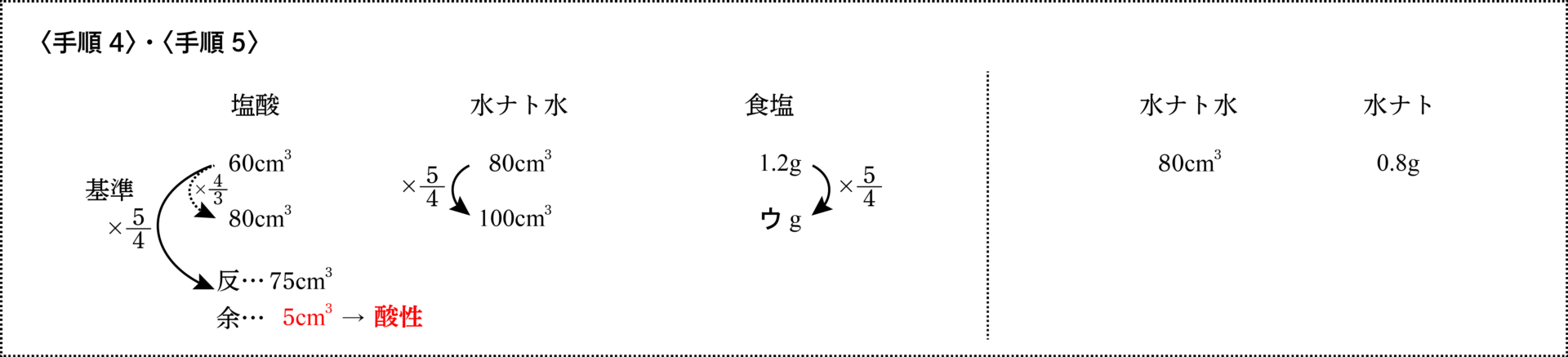 最小倍率である水酸化ナトリウム水溶液$100\rm{cm}^3$はすべて反応しますが、塩酸は余るので、混合液は酸性になります。
最小倍率である水酸化ナトリウム水溶液$100\rm{cm}^3$はすべて反応しますが、塩酸は余るので、混合液は酸性になります。
反$=60× \frac{5}{4}=75\rm{cm}^3$……反応した塩酸
余$=80-75=5\rm{cm}^3$……余った塩酸
そして、蒸発させたときに残る固体は混合液が酸性になっているので、食塩のみです。
ウ$=1.2× \frac{5}{4}=\underline{1.5\rm{g}}$ …… できる食塩の重さ$=$蒸発後に残った固体の重さ
【解説】(3)を手順通りに解く
 塩酸は基準の$\frac{5}{4}$倍に、水酸化ナトリウム水溶液は基準の$\frac{3}{2}$倍になっています。
塩酸は基準の$\frac{5}{4}$倍に、水酸化ナトリウム水溶液は基準の$\frac{3}{2}$倍になっています。
この場合は、最小倍率である$\frac{5}{4}$倍を用いて計算をします。
(つまり、大きい方の倍率は計算に使いません。)
 最小倍率である塩酸$75\rm{cm}^3$はすべて反応しますが、水酸化ナトリウム水溶液は余るので、混合液はアルカリ性になります。
最小倍率である塩酸$75\rm{cm}^3$はすべて反応しますが、水酸化ナトリウム水溶液は余るので、混合液はアルカリ性になります。
反$=80× \frac{5}{4}=100\rm{cm}^3$ ……反応した水酸化ナトリウム水溶液
余$=120-100=20\rm{cm}^3$ ……余った水酸化ナトリウム水溶液
そして、蒸発させたときに残る固体は混合液がアルカリ性になっているので、食塩と水酸化ナトリウムの2種類が残ります。
エ$=1.2× \frac{5}{4}=\underline{1.5\rm{g}}$…… できる食塩の重さ
オ$=0.8× \frac{1}{4}=\underline{0.2\rm{g}}$…… 余った水酸化ナトリウム水溶液に含まれる水酸化ナトリウムの重さ
よって、蒸発させたときに残る固体の重さの合計は、
$1.5+0.2=\underline{1.7\rm{g}}$
化学計算は「手順の順守」が成否を分ける
化学計算を苦手にする受験生は、解くうえで必要な手順がいい加減になっていることが多くあります。
今回は中和反応計算のイロハ(入門編)を解説しました。またの機会に表やグラフから基準(当量点)を見つける問題の解き方を紹介したいと思います。